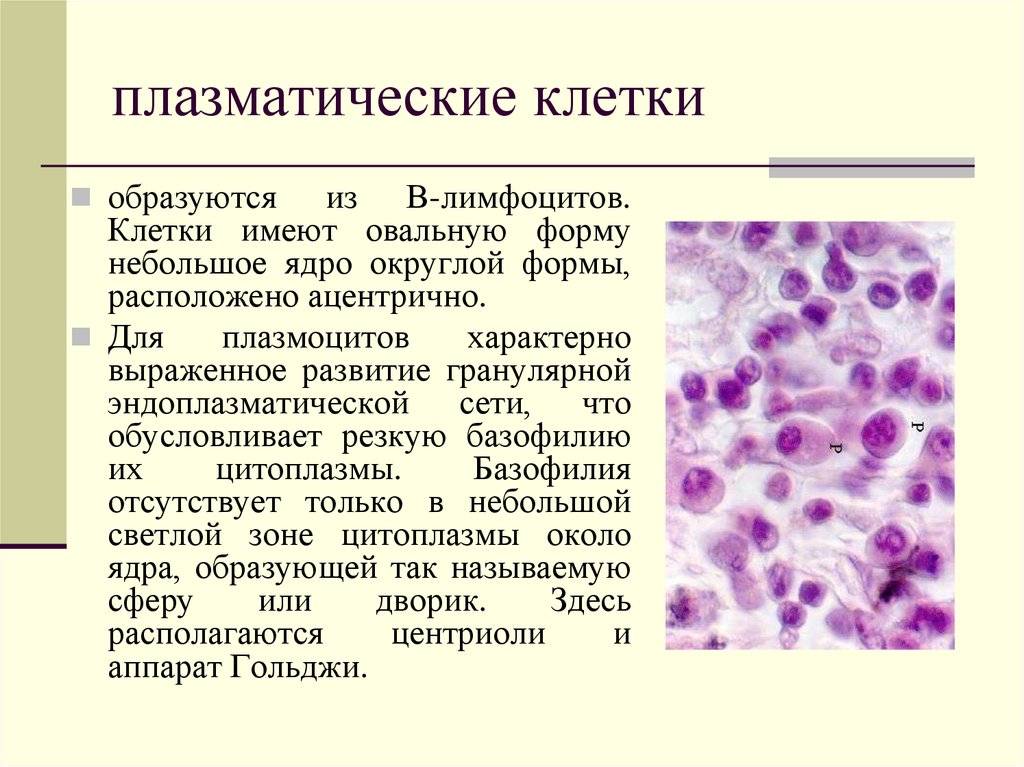
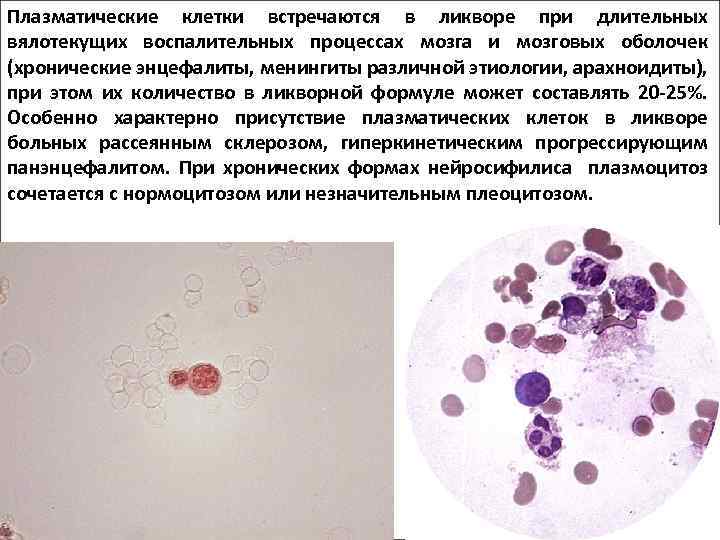
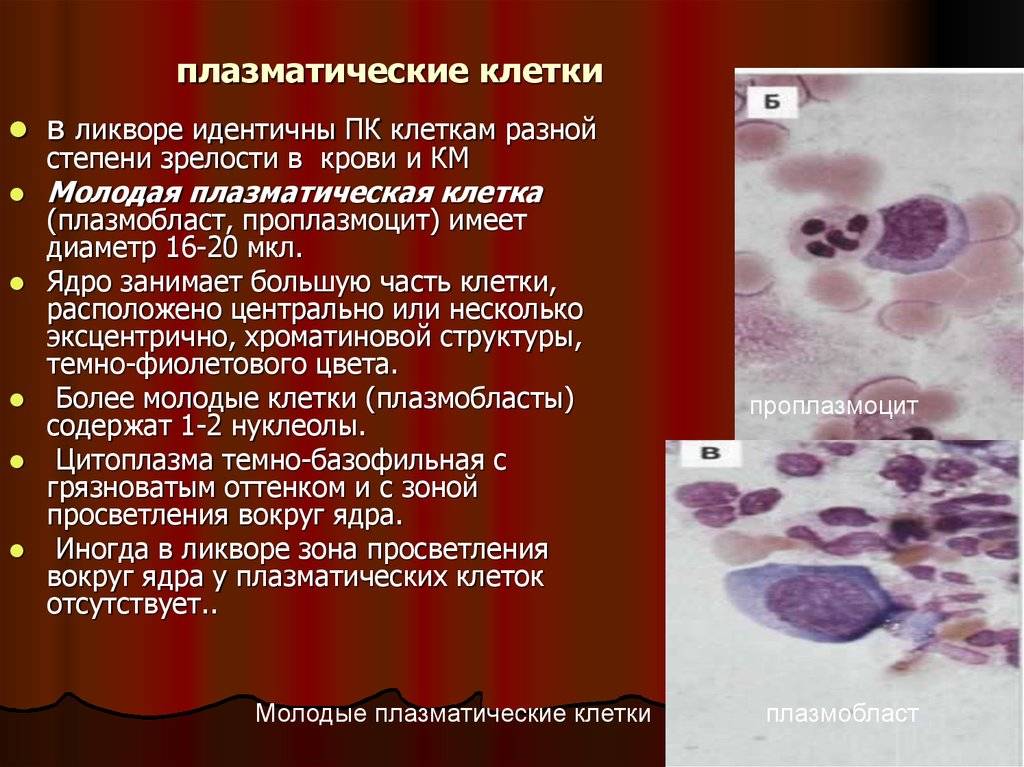
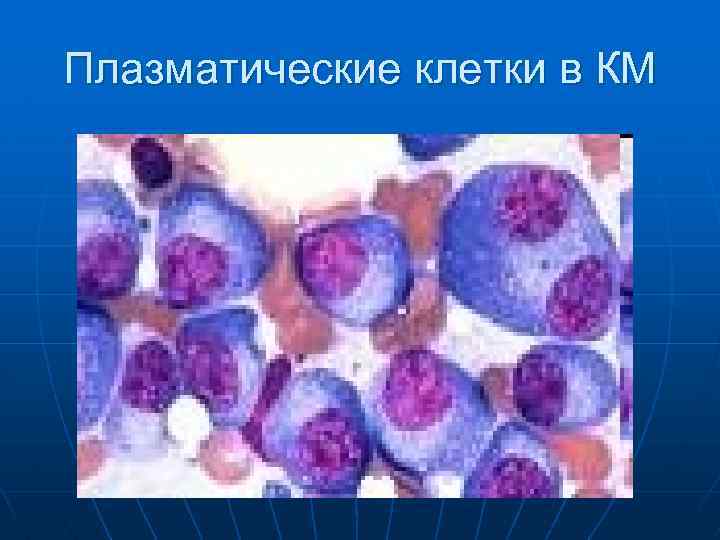
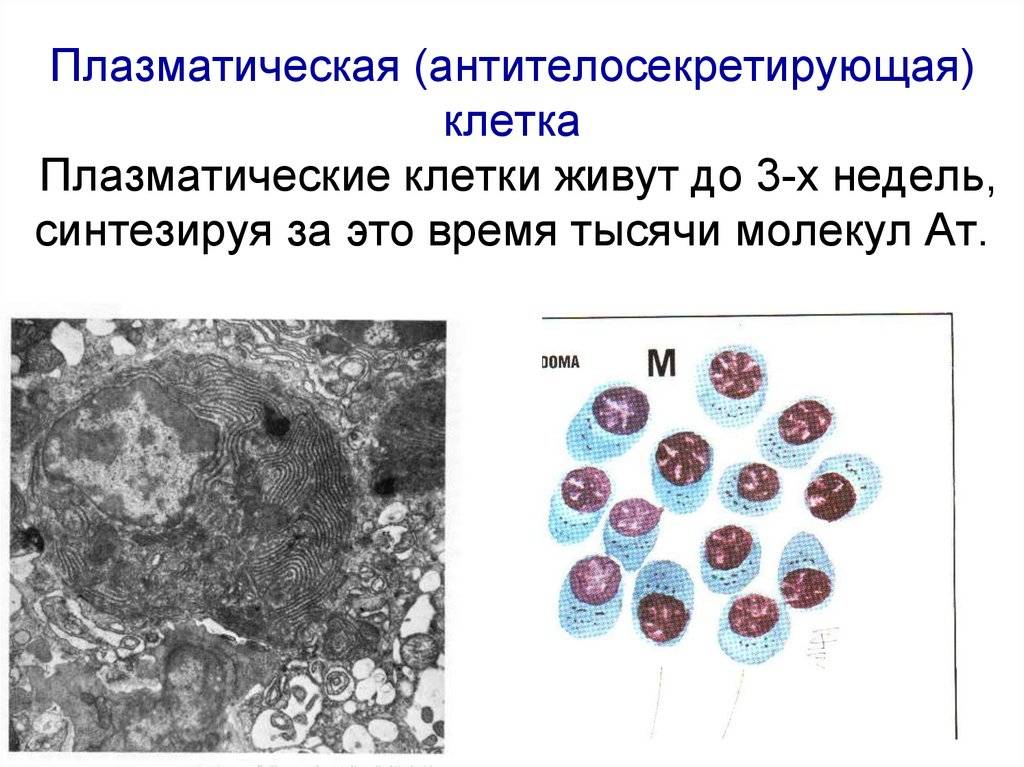
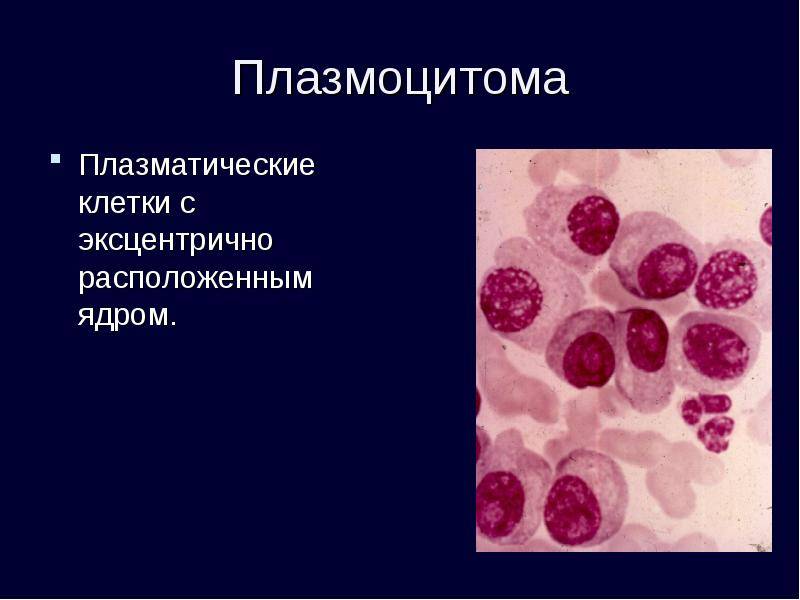
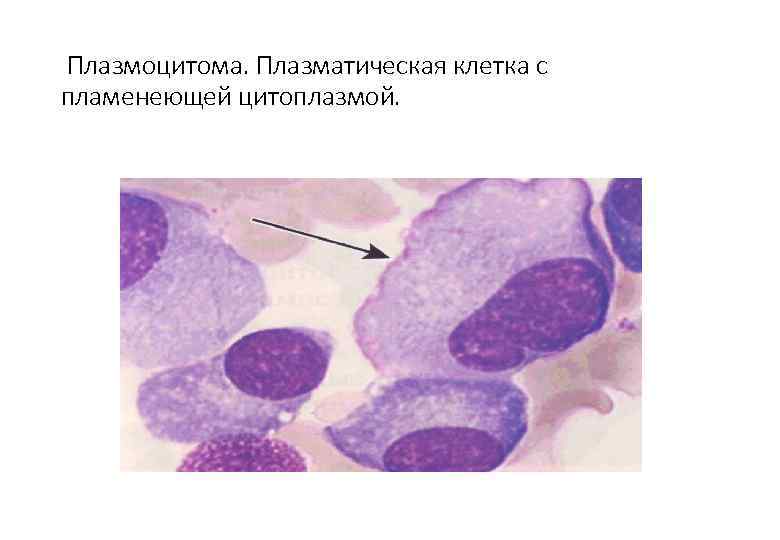
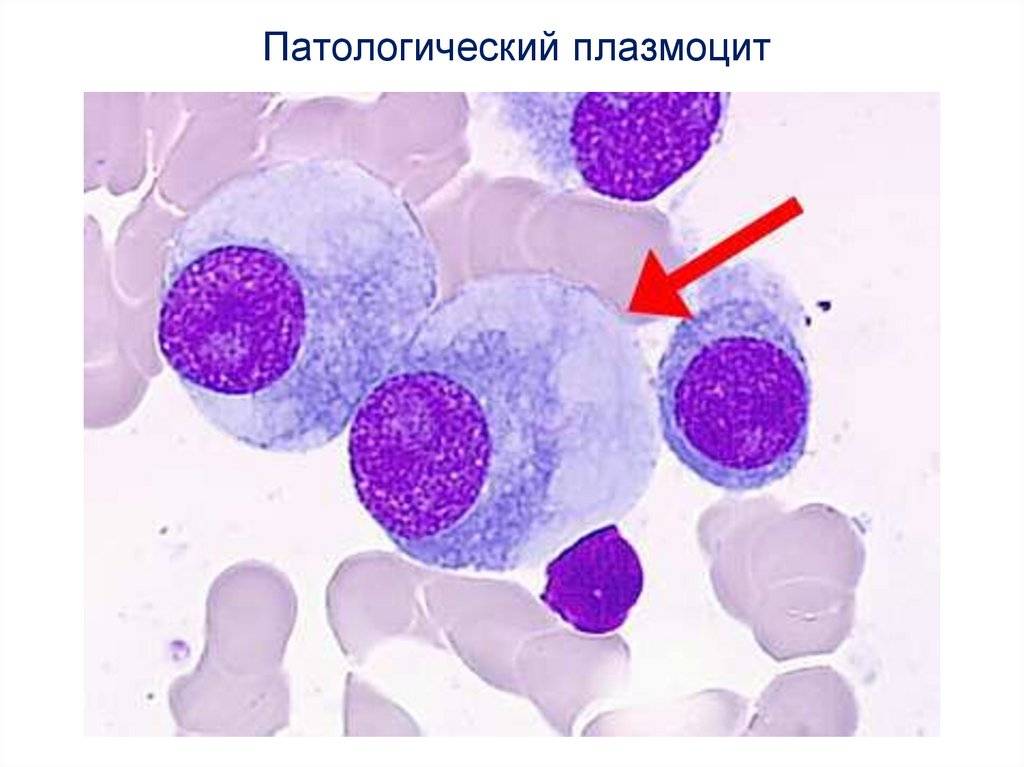
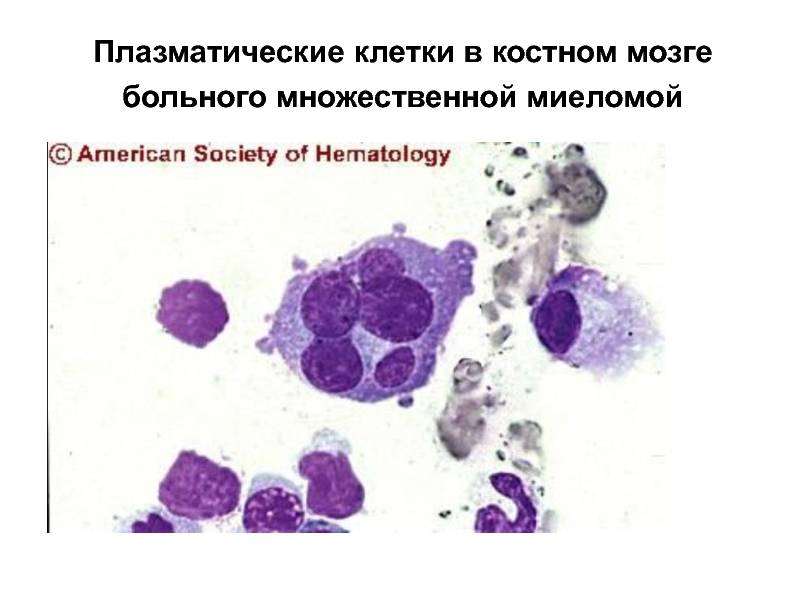
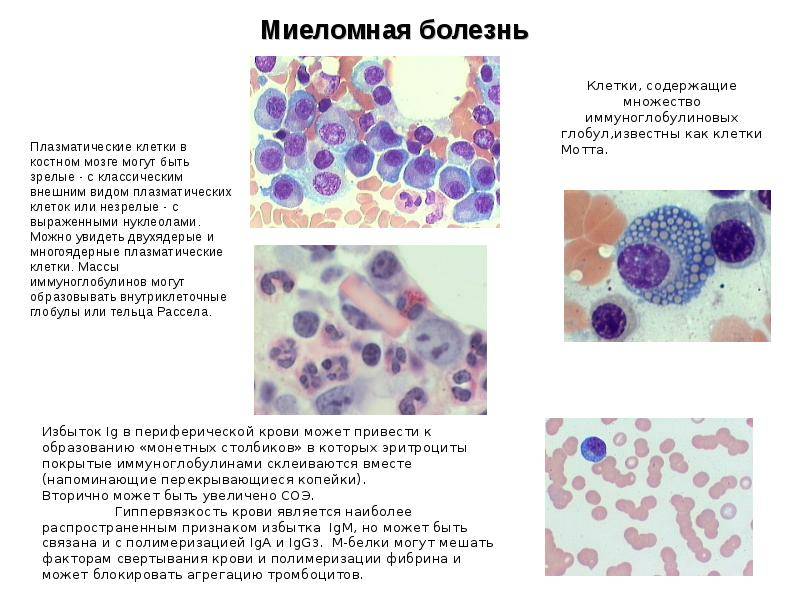
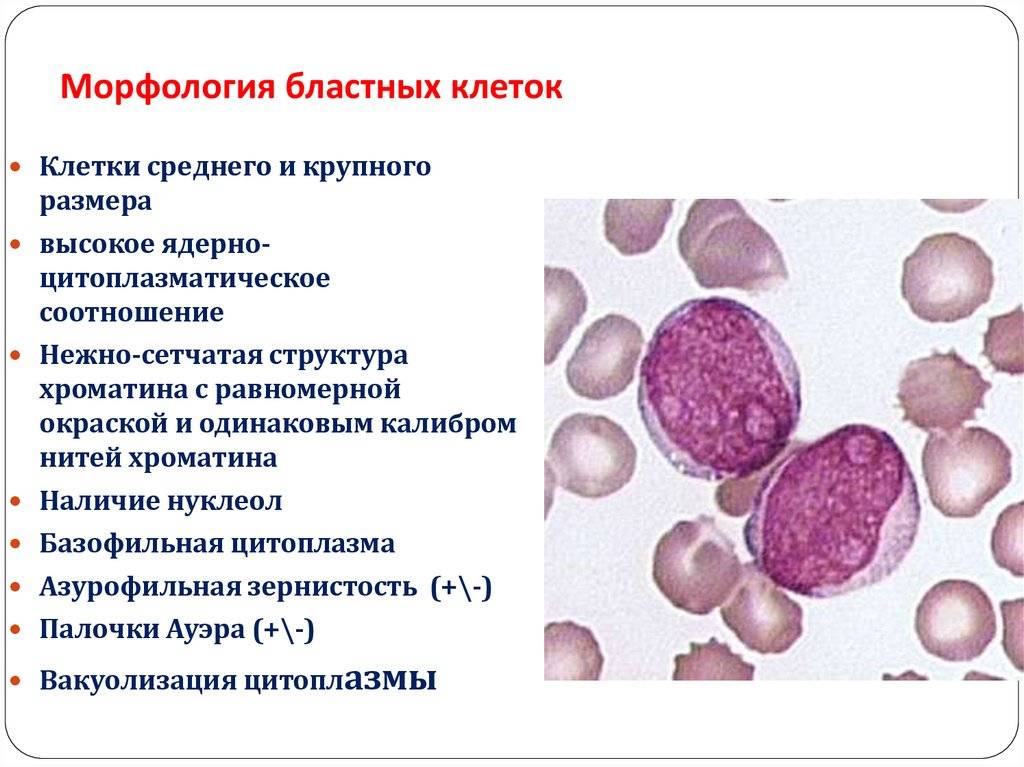
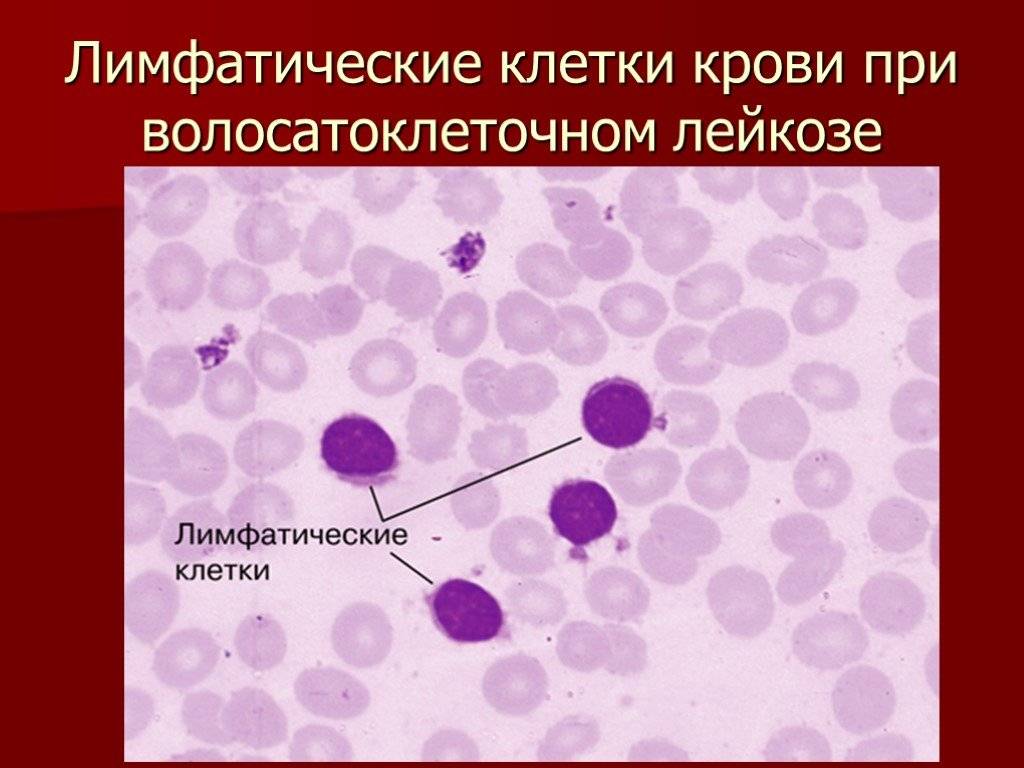
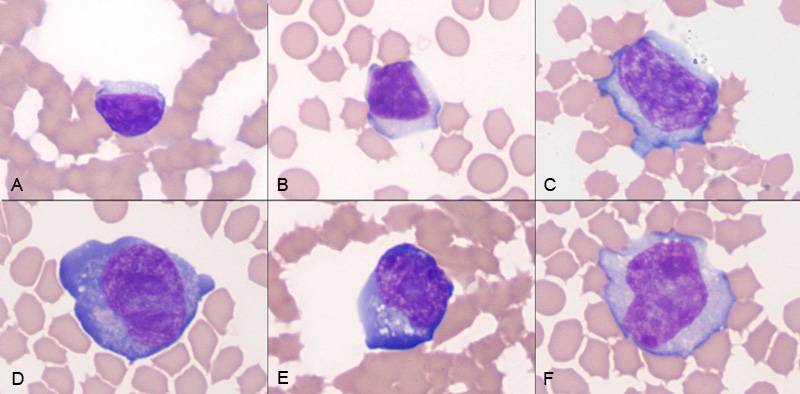
Поражение почек.
Существует несколько механизмов поражения почек при множественной миеломе. Легкая степень почечной недостаточности, оцениваемая как снижение СКФ ниже 60 мл/мин/1,73 м2, обнаруживается у 20% больных миеломой на этапе диагноза и примерно у половины больных в ходе миеломной болезни. Причины поражения почек комплексные и включают дегидратацию, гиперкальциемию, инфекции, воздействие нефротоксических лекарств, в частности, прием больших доз НПВС для купирования болевого синдрома.
Наиболее характерно для миеломы обнаружение тубулоинтестинального повреждения почек, известного как цилиндровая нефропатия, которая является прямым следствием повышенного содержания свободных легких цепей иммуноглобулинов в крови. Клетки канальцевого эпителия повреждаются и атрофируются из-за усиленного «переноса» свободных цепей из просвета канальцев в интерстиций. На фоне обезвоживания может развиться синдром острой почечной недостаточности, обусловленный нарушением кровотока и канальциевыми нарушениями.
Наличие легких цепей в моче при миеломной болензи может вызвать нарушение функции почек, известное как вторичный синдром Фанкони. Он обусловлен недостаточностью реабсорбционной способности проксимальных канальцев, что проявляется глюкозурией, аминоацидурией, гипофосфатемией и гипоурикемией.
В интерстиции развивается процесс воспаления с итоговым тубуло-интерстициальным фиброзом, приводящим к почечной недостаточности. Более того, невыведенные почками моноклональные легкие цепи могут откладываться в почках, сердце, печени, тонком кишечнике, нервных стволах, приводя к развитию первичного амилоидоза (AL-амилоида) или болезни отложения легких цепей (light-chain deposition disease — LCDD англ, БОЛЦ). Для диагностики почечной недостаточности требуется определение креатинина, мочевины, натрия и калия, кальция и оценка СКФ по формуле MDRD или CKD-EPI. Также рекомендуется измерение общего белка, электрофорез и иммунофиксация в образцах 24-часовой мочи. У больных с неселективной протеинурией или селективной альбуминурией требуется исключить наличие амилоидоза или MIDD , для чего показана биопсия почки или подкожного жира с окраской конго-рот. У больных с протеинурией свободных легких цепей (белка Бенс-Джонса) биопсия жира не обязательна, поскольку в этом случае диагноз миеломного повреждения почек не вызывает сомнений и требует планирования терапии основного заболевания.
Свободные легкие цепи имеют высокую чувствительность и специфичность по сравнению с электрофорезом белков в моче. Больные с почечной недостаточностью при ММ имеют повышенное каппа/лямбда отношение даже при отсутствии доказательств моноклональной гаммапатии. Причина состоит в нарушении выделения легких цепей. У здоровых людей очищение крови от легких цепей осуществляется почками. Каппа цепи являются мономерными и быстрее покидают кровь сравнительно с лямбда цепями, что доказывается каппа/лямбда отношением в среднем 0.6 у лиц без поражения почек. У больных с почечной недостаточностью основной системой очищения становится ретикуло-эндотелиальная система, полупериод жизни каппа цепей из-за этого удлиняется. Отношение каппа/лямбда оказывается при почечной недостаточности равным в среднем 1.8. Свободные легкие цепи имеют высокую чувствительность и специфичность, и больные с почечной недостаточностью имеют повышенное каппа/лямбда отношение вследствие нарушения клиренса каппа и лямбда цепей.
Патологическая анатомия
Патологоанатомическими признаками агранулоцитоза являются некротически-язвенные изменения, наиболее часто встречающиеся в полости рта и глотки. Миндалины увеличенные, рыхлые, серо-грязного вида, с фибринозными наложениями и изъязвлениями. В области мягкого и твердого неба обнаруживаются очаги некроза, иногда с перфорацией мягкого неба. Некротические изменения выявляются в коже, в местах инъекций, в области промежности, вокруг анального отверстия. Очаги некроза описаны в конъюнктивальном мешке, в слизи стой оболочке гортани, пищевода и желудка. При развитии некроза в слизистой оболочке тонкой или толстой кишки, включая червеобразный отросток, наблюдаются кишечные кровотечения, перфорации. Некротические язвы могут быть в стенке мочевого пузыря, в половых органах, особенно в стенке влагалища, а также в ткани печени и других органов. Микроскопическое исследование показывает, что в участках некроза отсутствуют нейтрофильные лейкоциты. Демаркационная полоса вокруг некроза не выявляется, вблизи участков некроза можно видеть лимфо-гистиоцитарные и плазмоклеточные скопления. Пневмонии носят характер фибринозно-геморрагических. При этом фибринозные наложения располагаются и на плевре. В зоне пневмонии могут выявляться участки распада ткани (гангрена). Микроскопически в просветах альвеол видны слущенные клетки эпителия, бактерии, дрожжевые клетки и их мицелий. Лимфатические узлы обычно не увеличены. При некротических изменениях в полости рта может наблюдаться небольшое увеличение шейных и подчелюстных лимфатических узлов. Микроскопическая структура их относительно сохранена. В корковом слое и особенно в области мозговых тяжей выявляется большое количество плазматических клеток. Резко выражена пролиферация и набухание клеток ретикулоэндотелия в синусах. Селезенка чаще не изменена. Ткань селезенки мягковатой консистенции, на разрезе — пульпа розово-серого цвета с большим соскобом
При микроскопическом исследовании обращает на себя внимание равномерное уменьшение количества клеток красной пульпы селезенки. Костный мозг плоских костей макроскопически чаще обычного вида, несколько суховат, но могут быть различные очаги кровоизлияния — от мелких до обширных; в нижней и средней трети трубчатых костей костный мозг жировой.
Микроскопически выявляются небольшие очаги рассасывания костных балок с образованием мелких лакун. В зонах рассасывания кости может наблюдаться пролиферация остеобластов. Соотношение жировой и кроветворной ткани различно. Чаще имеет место уменьшение числа кроветворных клеток и увеличение количества жировых клеток костного мозга
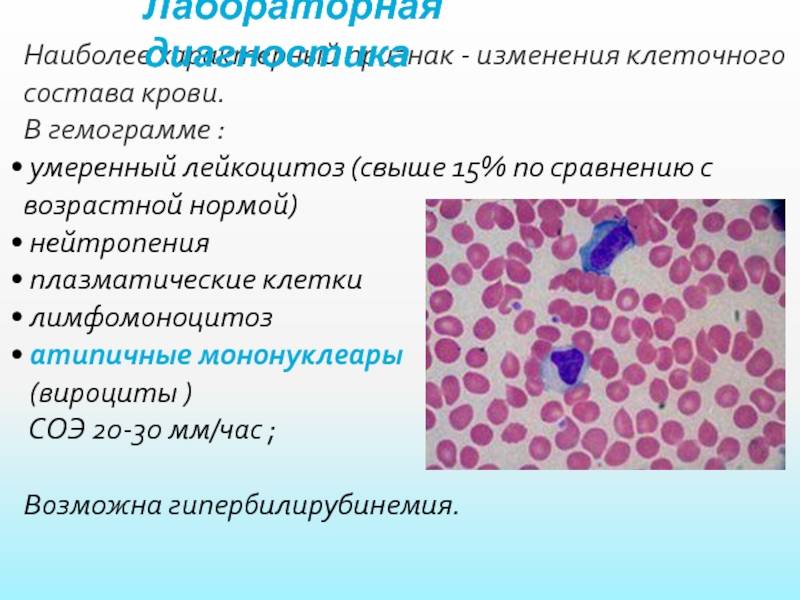
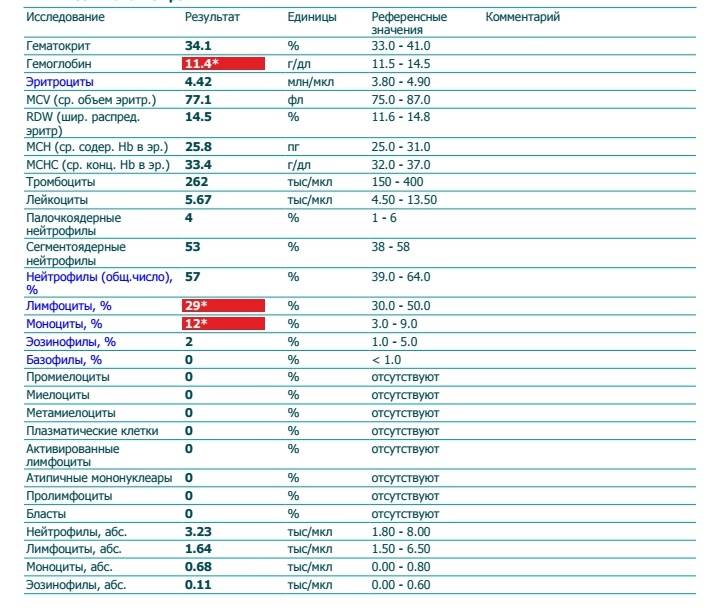
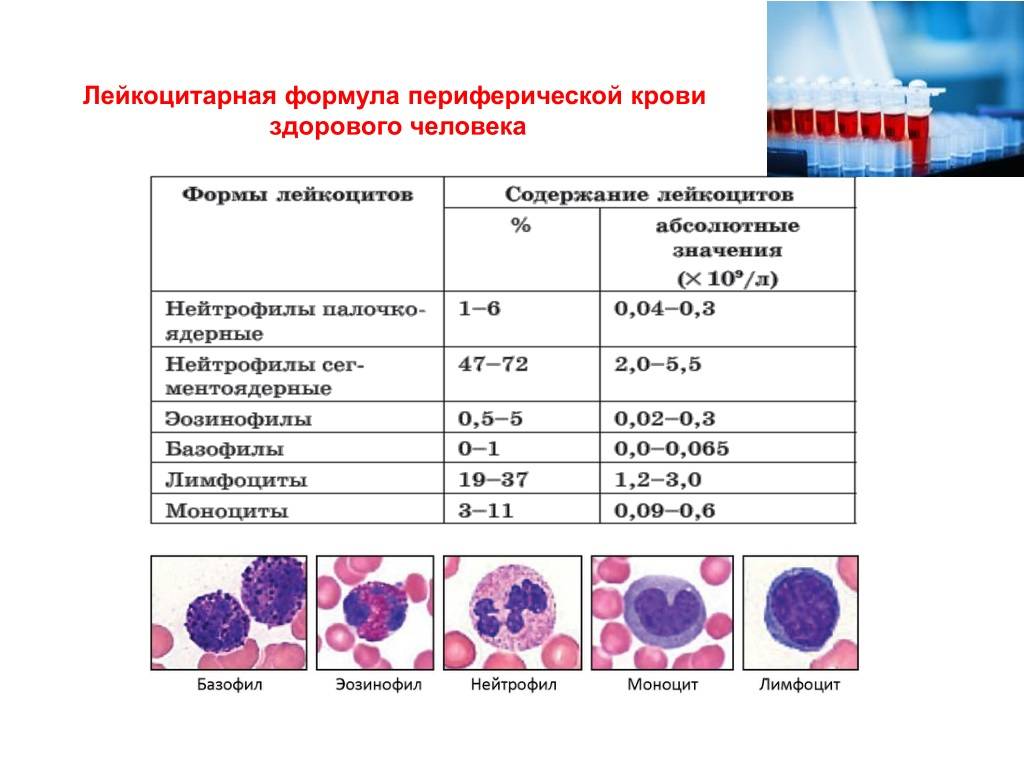
В клеточном составе обращает на себя внимание резкое уменьшение числа юных, палочкоядерных и сегментоядерных гранулоцитов. Может наблюдаться некоторое преобладание молодых форм гранулоцитов
Мегакарпоциты и клетки красного ряда, как правило, сохраняются. При наиболее тяжелом течении АГРАНУЛОЦИТОЗА картина костного мозга та же, что и при гипопластической анемии (см.).
Поражение костей
Остеолитические разрушения костей являются центральным проявлением миеломной болезни и присутствуют у почти 80% пациентов во время установления диагноза. Генерализованное разрушение костей приводит к гиперкальциемии, ускоренному остеопорозу, формированию кифоза, клиновидным переломам позвонков. Стойкие изнурительные боли в костях являются ведущими жалобами, заставляющим больных впервые обратиться к врачу. К регулярным зонам поражения относится позвоночник и тазовые кости, что заканчивается переломами разных видов и возможной компрессией спинного мозга.
Доказано, что взаимодействие миеломных клеток с микроокружением в костном мозге приводит к выработке цитокинов, обуславливающих высокую активность остеокластов и пониженную деятельность остеобластов. Поэтому не обнаруживается признаков репарации кости в местах разрушений. Применение бифосфонатов, рентгенотерапии, балонной кифопластики и реконструктивной хирургии являются главными средствами реабилитации больных при разрушении костей. Однако костные разрушения сохраняются даже при излечении активной стадии болезни. Для выявления очагов остеолиза в костях скелета использую различные средства визуализации от рентгенографии всех костей и низкодозной комьютерной томографии до МРТ и ПЭТ всего тела. Наличие более одного фокуса лизиса в костях размером более 5 мм рассматривается как показание к назначению терапии для профилактики дальнейшего разрушения при отсутствии болевого синдрома.
Обязательной терапией деструкции и болевого синдрома при миеломной болезни в настоящее время является назначение бифосфонатов. Эти препараты были первоначально предложены для лечения остеопороза. Но они не только уменьшают боли, укрепляют кости, но также тормозят прогрессирование миеломной болезни. В связи с выделением через почки и длительной задержкой в организме бифосфонаты способны вызвать тяжелое поражение почек, простуду и гипокальциемию. Поэтому требуется мониторирования функции почек, а также электролитов (кальция и фосфора) при внутривенной терапии бифосфонатами.
Клиническая картина
Миелотоксический АГРАНУЛОЦИТОЗ начинается исподволь: без каких-либо субъективных признаков. Иммунный АГРАНУЛОЦИТОЗ клинически может иметь различные варианты в зависимости от вызвавшего его фактора. АГРАНУЛОЦИТОЗ на фоне коллагеноза развивается постепенно и отличается упорством течения. Начало медикаментозного иммунного АГРАНУЛОЦИТОЗА в большинстве случаев острое.
Первыми проявлениями любого АГРАНУЛОЦИТОЗА являются лихорадка, стоматит, ангина. При миелотоксическом синдроме отмечается и обычно умеренно выраженный геморрагический синдром (синяки и кровоточивость десен, носовые кровотечения): выраженный геморрагический синдром — нечастое осложнение АГРАНУЛОЦИТОЗА Поражение слизистых оболочек (некрозы и молочница) полости рта и желудочно-кишечного тракта — наиболее постоянный признак АГРАНУЛОЦИТОЗА. При миелотоксическом АГРАНУЛОЦИТОЕ оно обусловлено тем, что, с одной стороны, исчезновение гранулоцитов делает возможной микробную инвазию, с другой — подавление митозов эпителиальных клеток слизистой оболочки цитостатическими факторами нарушает ее целостность.
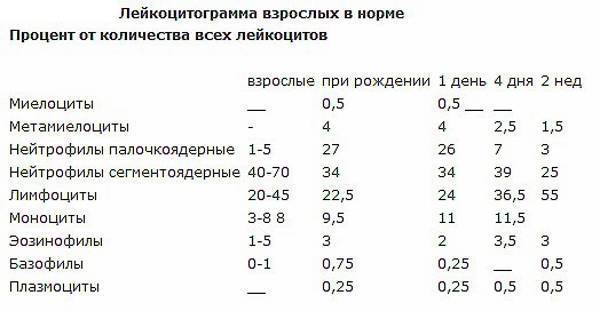
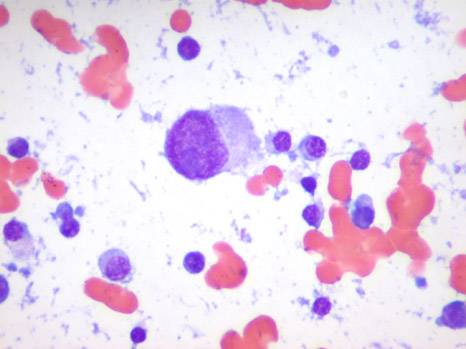
В периферической крови уменьшается количество всех форм лейкоцитов (нередко до сотен клеток в 1 мкл), а также тромбоцитов и ретикулоцитов. Число плазматических клеток обычно увеличено. Может быть анемия. Иногда гранулоциты исчезают полностью. Лейкопения при иммунном АГРАНУЛОЦИТОЗЕ носит умеренный характер — 1000—2000 клеток в 1 мкл, но количество гранулоцитов, как правило, уменьшается до нуля; тромбоцитопения отсутствует. В сыворотке обнаруживаются антилейкоцитарные антитела.
На высоте миелотоксического АГРАНУЛОЦИТОЗА в костном мозге почти полностью исчезают как гранулоцитарные элементы, так и эритронормобласты, мегакариоциты; лимфоидные, ретикулярные и плазматические клетки сохраняются. За 2—3 дня до выхода из состояния АГРАНУЛОЦИТОЗА в костном мозге появляются в огромном количестве промиелоциты и единичные нормобласты. В периферической крови первым признаком активации кроветворения является обнаружение молодых элементов — миелоцитов и метамиелоцитов, иногда плазматических клеток. Часто за 2—3 дня до появления гранулоцитов увеличивается число тромбоцитов и ретикулоцитов.
В костном мозге при иммунном АГРАНУЛОЦИТОЗЕ отмечается уменьшение клеточных элементов исключительно за счет гранулоцитарного ростка. Выход из иммунного АГРАНУЛОЦИТОЗА характеризуется появлением в периферической крови молодых клеток — миелоцитов, метамиелоцитов, иногда промиелоцитов.
Продолжительность АГРАНУЛОЦИТОЗА различна и зависит как от степени поражения костного мозга, так и от индивидуальных особенностей организма больного.
Инфекционные осложнения при множественной миеломе.
При миеломной болезни возрастает частота бактериальных и вирусных инфекций в 7-10 раз по сравнению с популяционным контролем. Гемофильная палочка, пневмонический стрептококк, кишечная палочка, грам-отрицательные бактерии и вирусы (грипп и герпес зостер) являются наиболее частыми виновниками инфекции у больных миеломной болезнью.
Повышенная чувствительность больных к инфекционным заболеваниям является результатом двух основных обстоятельств. Во-первых, влиянием самого заболевания, во-вторых, пожилым возрастом и побочным действием проводимой терапии. Лимфоцитопения, гипогаммаглобулинемия, нейтропения вследствие инфильтрации миеломными клетками костного мозга и под влиянием проводимой химиотерапии обуславливают повышенную чувствительность к инфекции. Связанная с болезнью недостаточность врожденного иммунитета вовлекает разные части иммунной системы и включает дисфункцию В-клеток, а также функциональные отклонения со стороны дендритных клеток, Т- клеток и натуральных киллеров (NK). Нарушения функции почек и легких, слизистой ЖКТ, мультиорганные нарушения, вызванные отложением легких цепей иммуноглобулинов, также увеличивают риск инфекционных заболеваний. Наконец, миеломная болезнь поражает преимущественно пожилых лиц с коморбидными возрастными заболеваниями и малоподвижным образом жизни, исходно предрасположенных к инфекциям.
Иммуномодуляторы и глюкокортикоиды являются частью лечения наиболее тяжелых вариантов заболевания. При имеющихся инфекционных контактах, наличии нейтропении и гипогаммаглобулинемии и подавленном клеточном иммунитете терапия иммуномодуляторами требует профилактического назначения антибиотиков.
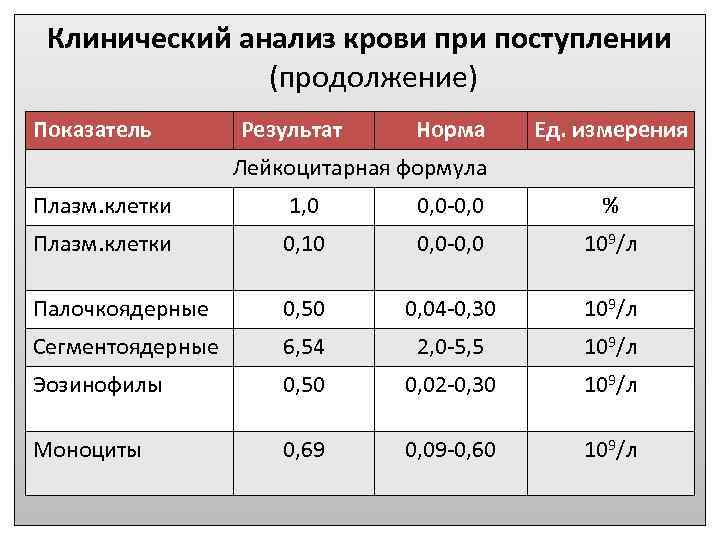
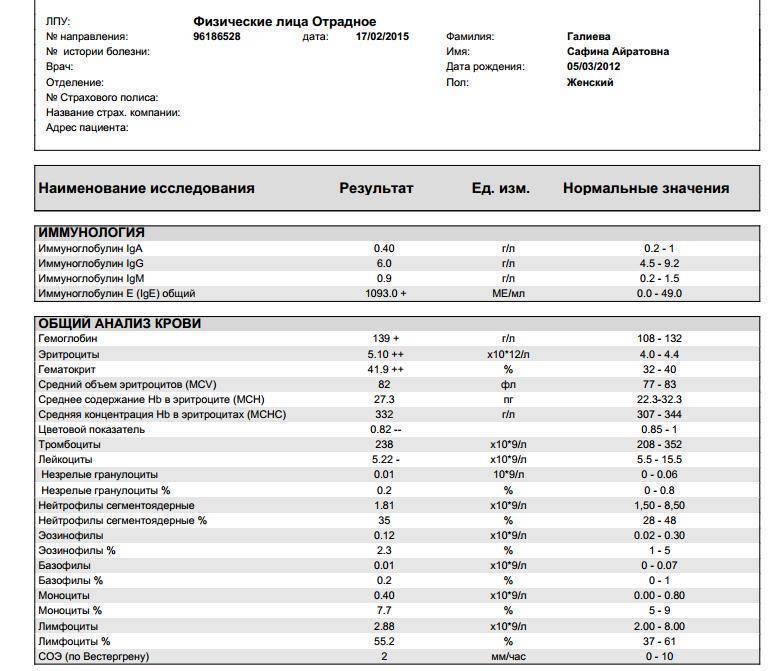
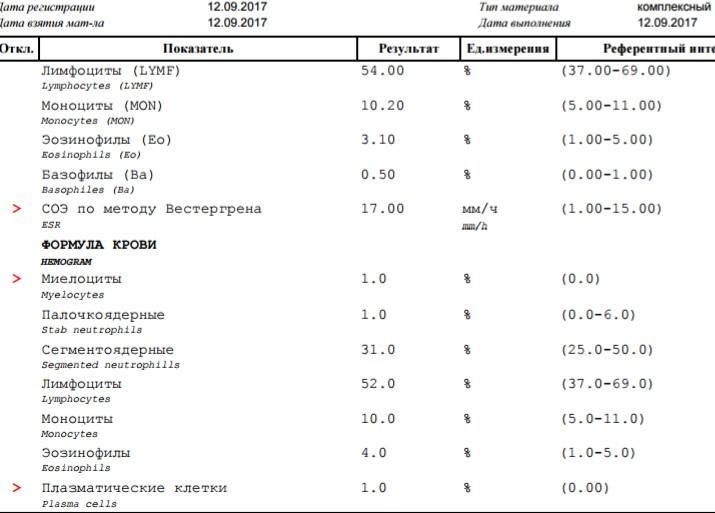
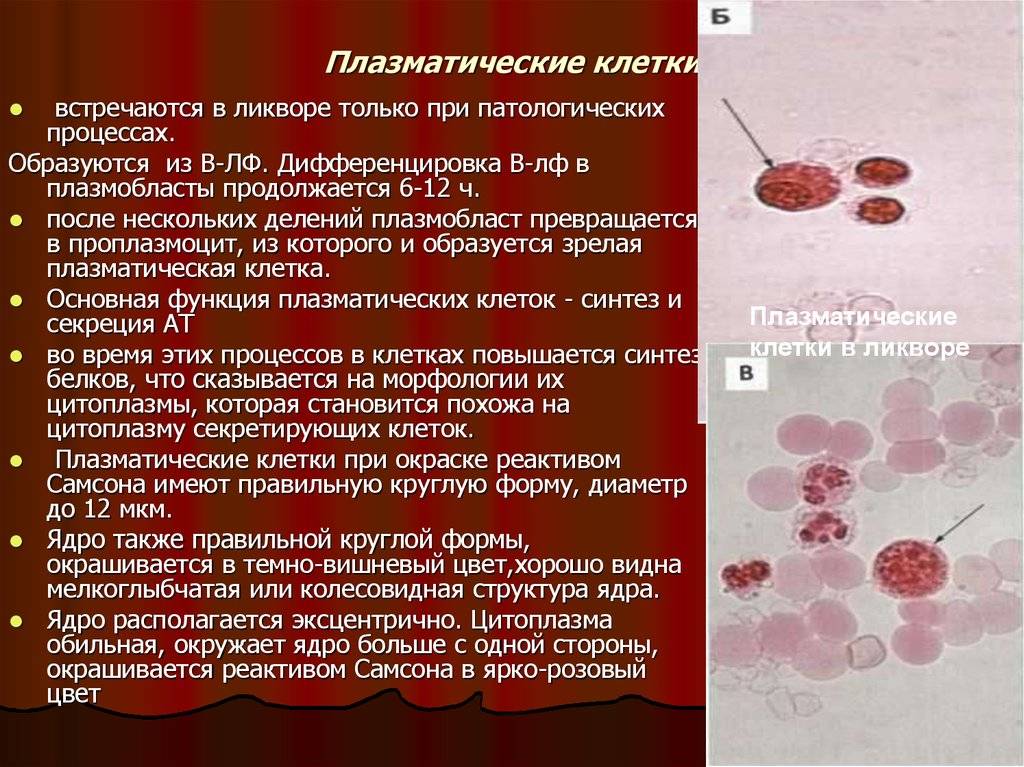
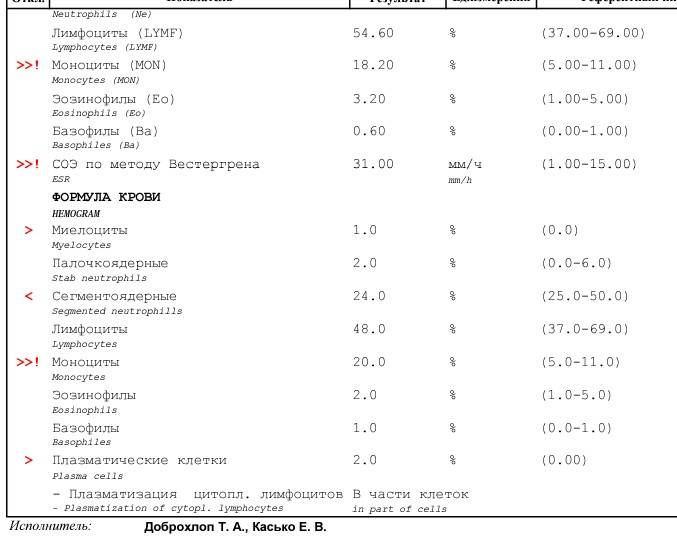
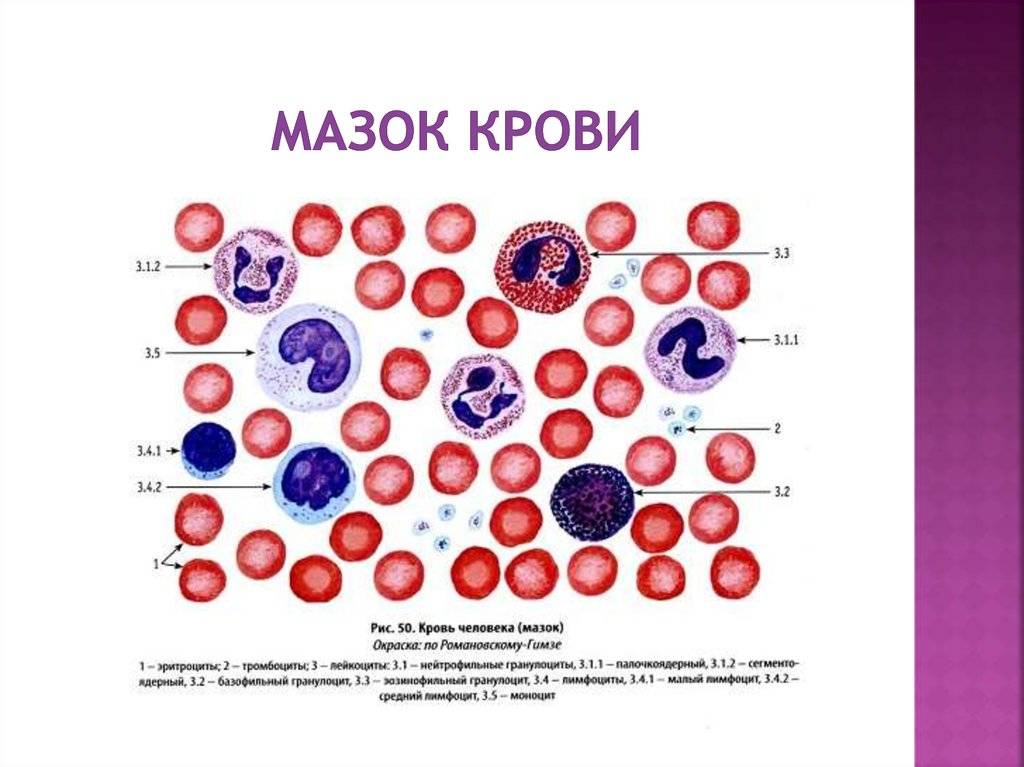
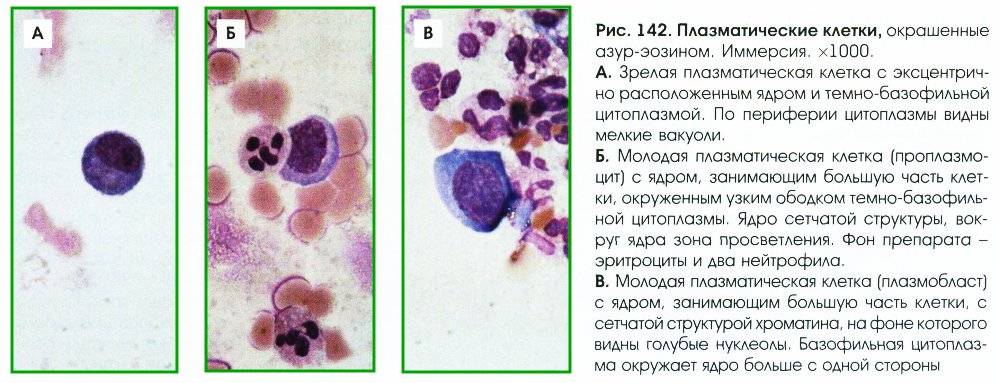
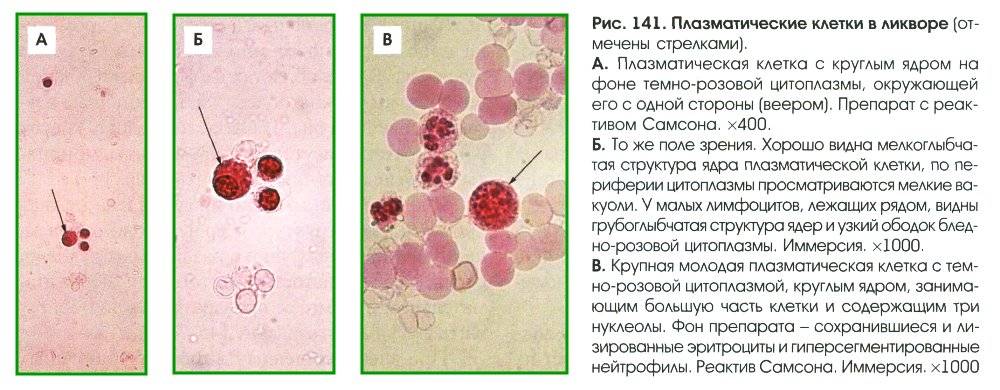
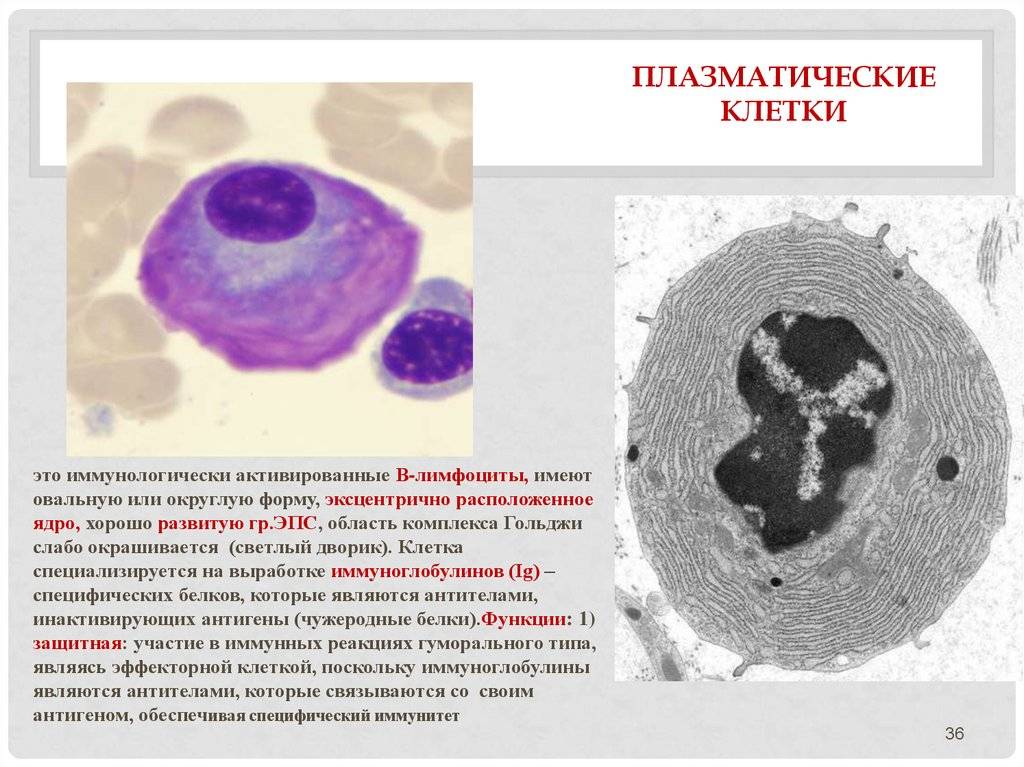
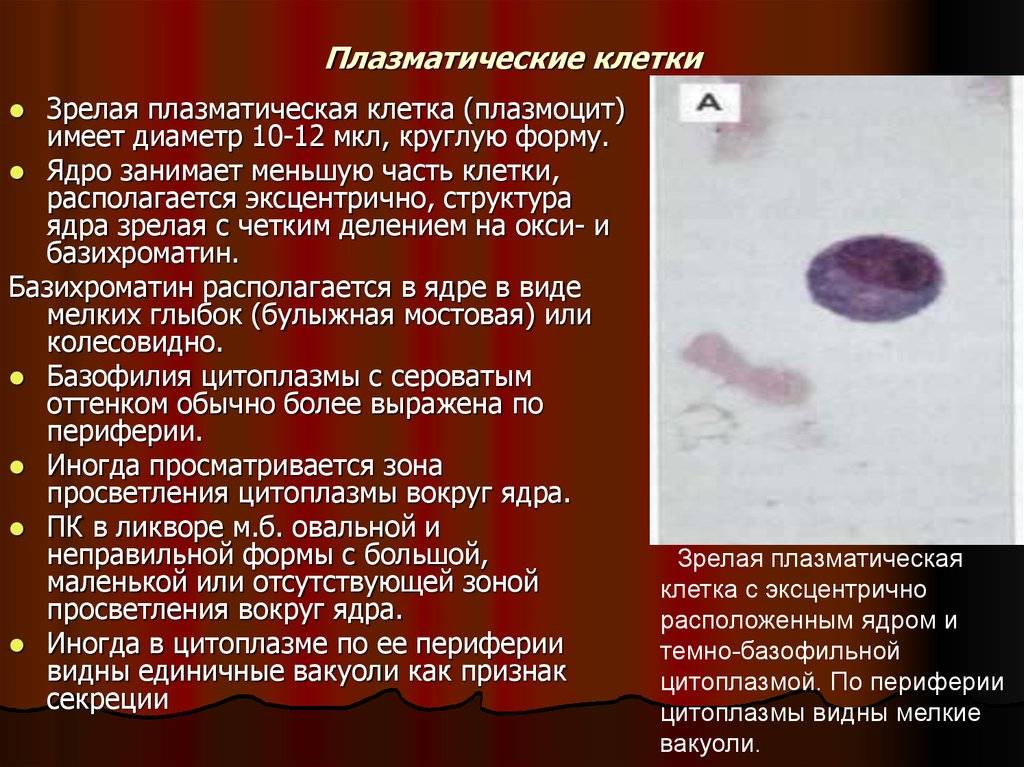
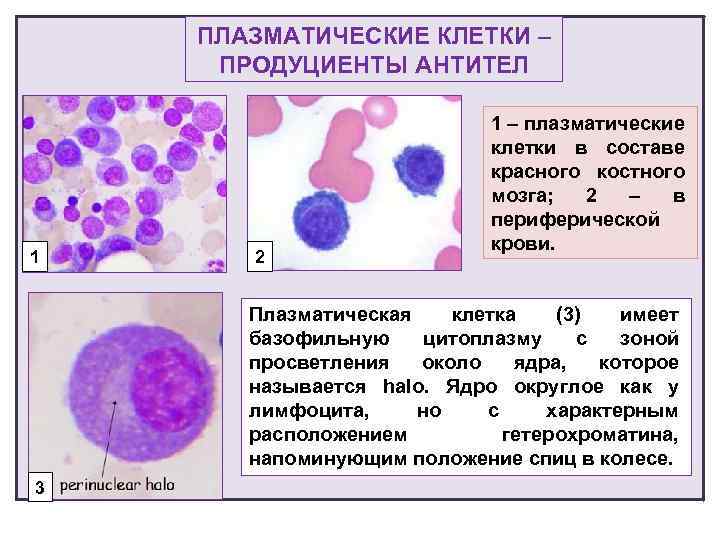
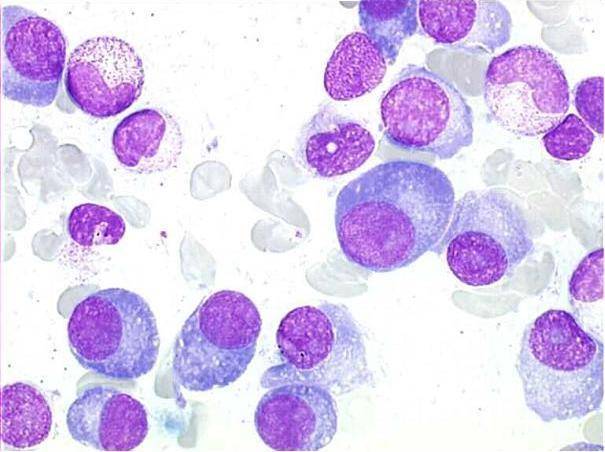
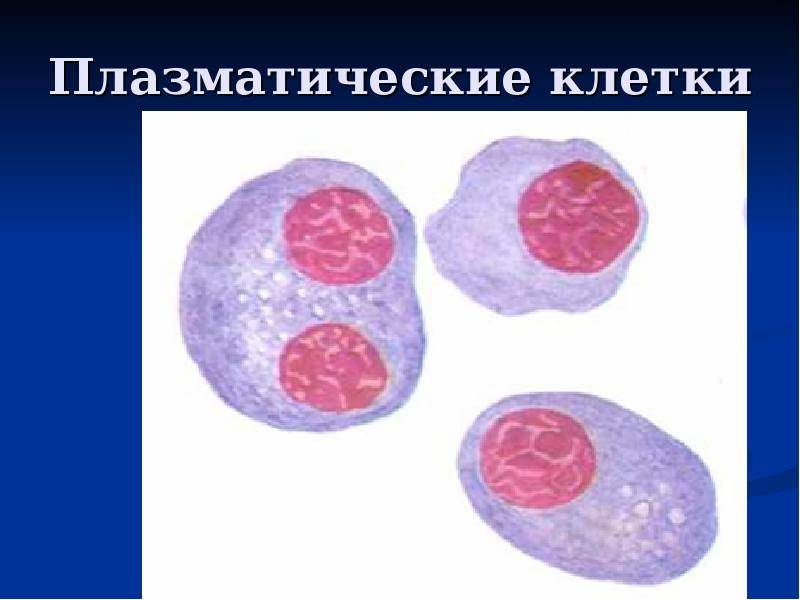
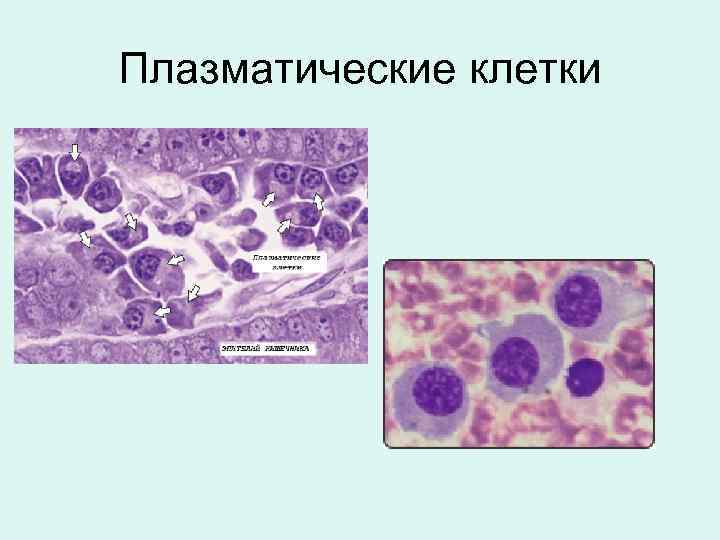
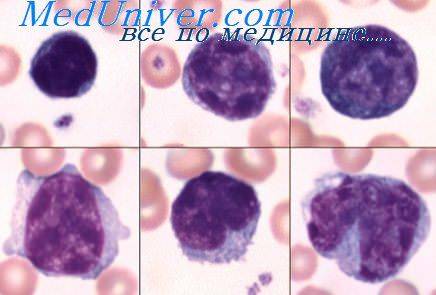
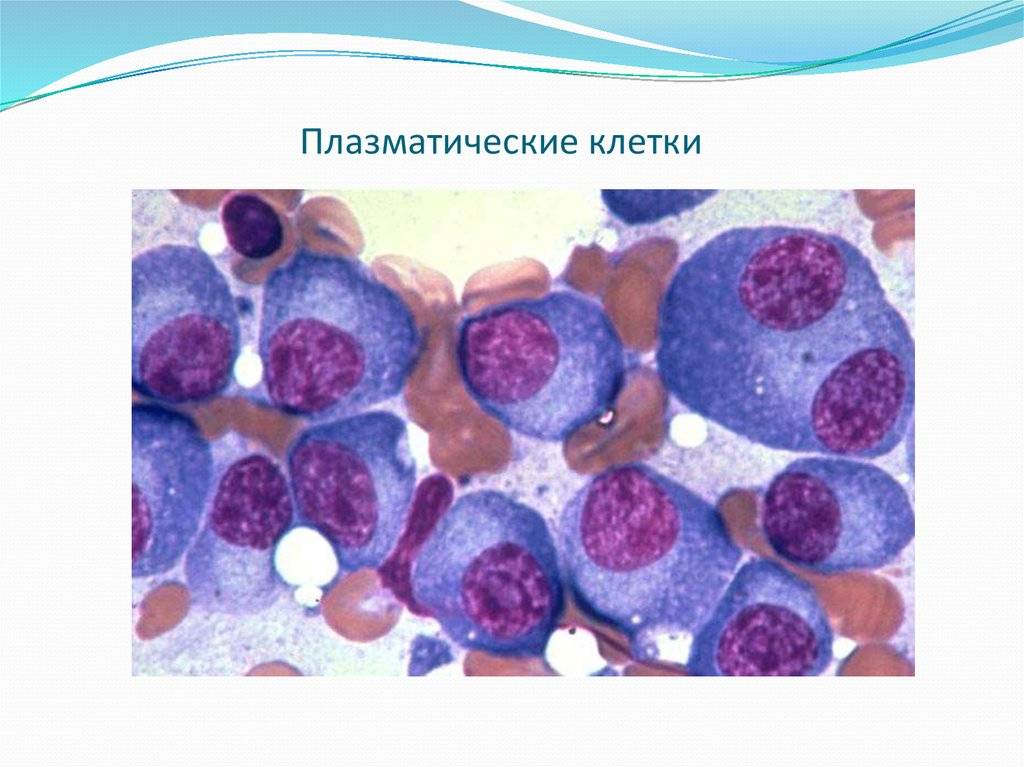
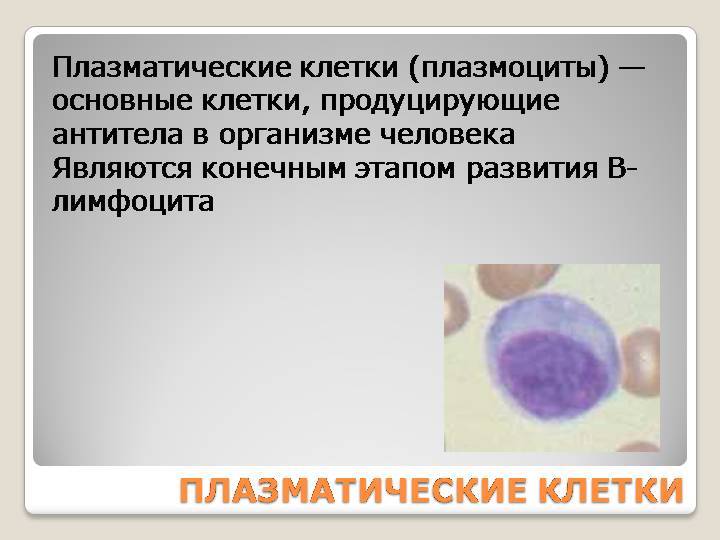
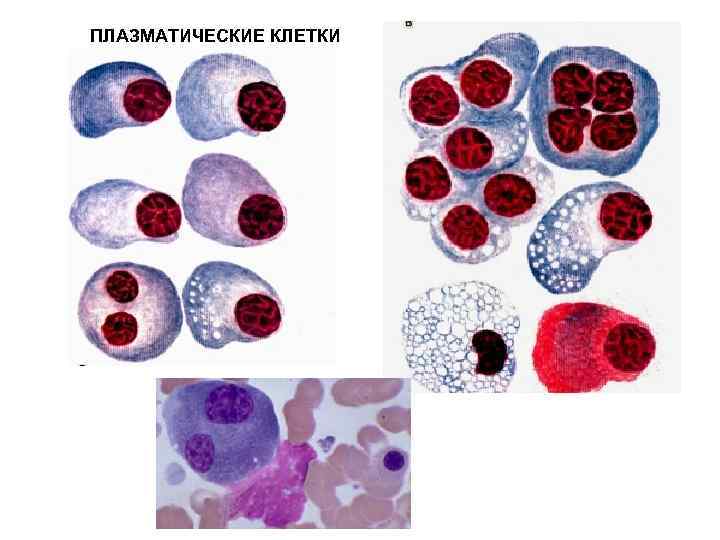
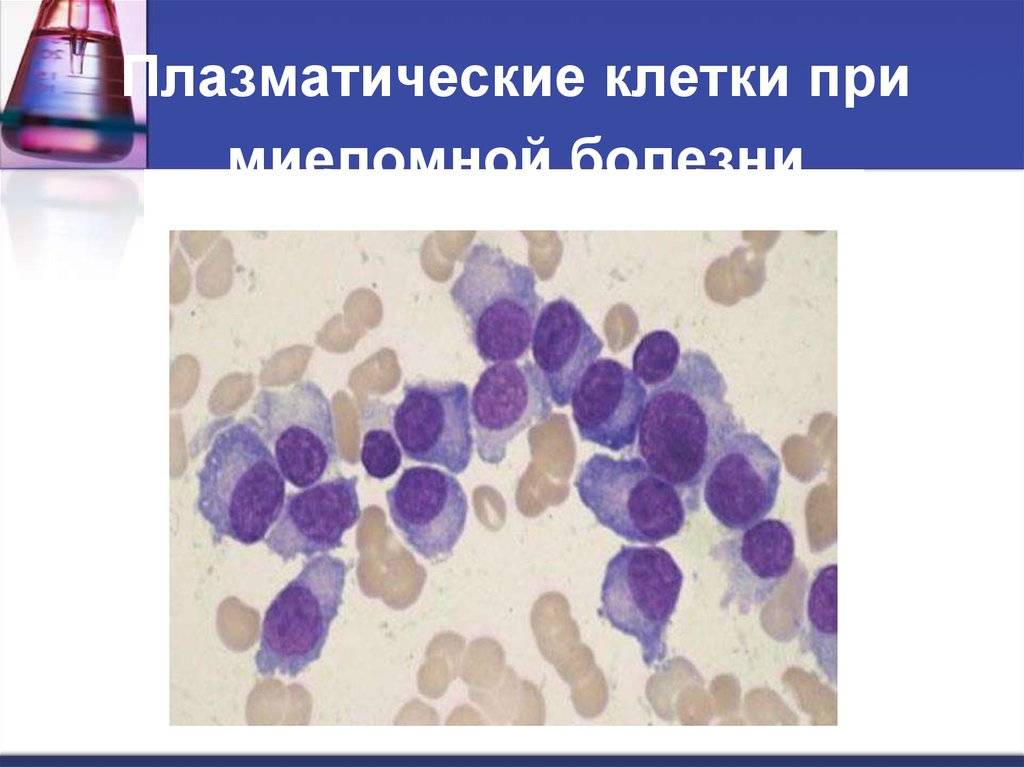
Патологии плазматических клеток
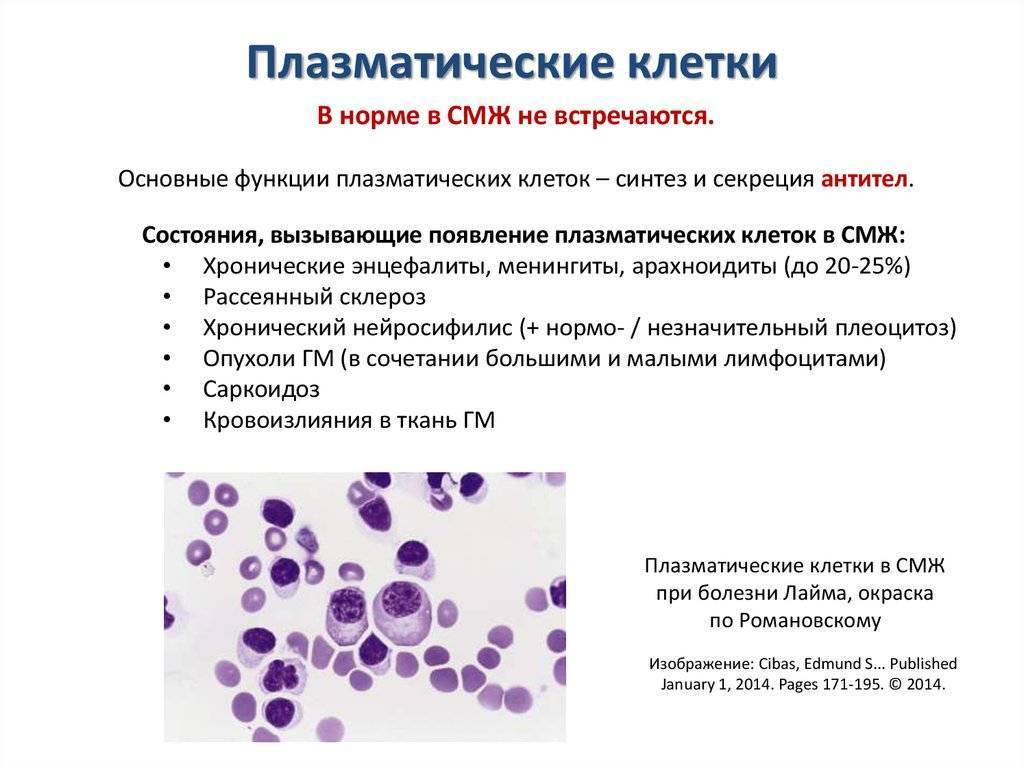
После выявления плазматических клеток в крови врач должен проверить, нет ли у них патологий. Таковыми могут быть злокачественные опухоли, которые нужно незамедлительно лечить.
//tvoianalizy.ru/www.youtube.com/watch?v=1R8qxKZpcBI
При наличии таких патологий плазматические клетки могут быть обнаружены даже в моче. Причиной этого может стать развитие злокачественных изменений в системе В-лимфоцитов. При проведении анализа из сыворотки крови выделяют моноклинальный протеин, который производится злокачественными клетками. Этот протеин называют «компонентом» и, в зависимости от его содержания в крови, оценивают, насколько велика образовавшаяся опухоль.
Таким образом, анализ крови может показать даже развитие злокачественной опухоли из плазматических клеток и вовремя побороть болезнь.
//tvoianalizy.ru/www.youtube.com/watch?v=j_frN_NwA-Y
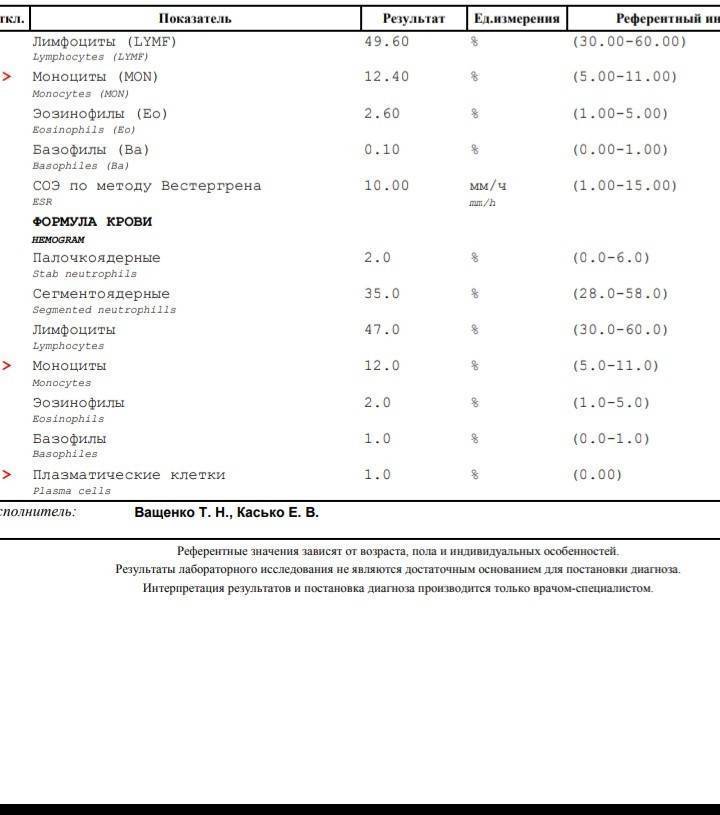
Благодаря общему анализу крови, хороший врач сможет вовремя диагностировать заболевание и назначить эффективное лечение. Общий анализ крови – это один из самых простых и доступных способов обнаружить плазмоциты в крови у пациента.
Показания и подготовка к анализу
Показанием для проведения анализа на гематокрит служат симптомы свидетельствующие о развитии анемии либо других заболеваний крови, кроветворной системы. В их число входят:
- Бледность либо желтушность кожи
- Увеличение селезенки, печени
- Изменения размеров лимфоузлов
- Нарушения пищеварения
- Проблемы с кожей и волосами (высыпания, язвы на слизистых, выпадение либо ломкость волос)
Особой подготовки к анализу на гематокрит не требуется. Нужно соблюдать стандартные правила проведения общего анализа крови:
- Кровь забирается рано утром.
- Не стоит употреблять пищу за 6-10 часов до анализа.
- Избегать алкоголя за 2-3 дня до процедуры.
Курящим пациентам рекомендуется воздержаться от курения минимум на 2-3 часа до забора крови. Если не соблюсти эти рекомендации анализ может дать недостоверные результаты. Это связано с тем, что состав крови подвержен сильным колебаниям в зависимости от действия разнообразных факторов внешней среды.
Прогнозировование и факторы риска при миеломе
«Международная система прогнозирования» (ISS. 2005) была разработана на основании данных естественного исхода заболевания значительной клинической группы больных и основана на исследовании бета-2 микроглобулина в динамике. Бета-2 микроглобулин повышен у 75% больных миеломной болезнью.
Выделено три уровня этого онкомаркера, которые связаны с длительной выживаемостью пациентов. Это позволяет определить несколько стадий заболевния.
- бета-2-микроглобулин менее 3,5 мг/л и альбумин более 35 г/л, средняя выживаемость 62 месяца,
- промежуточная между 1 и 3 стадиями, средняя выживаемость 44 месяца.
- бета 2-микроглобулин более 5.5 мг/л, средняя выживаемость 29 мес.
Однако, в настоящее время использование новых препаратов значительно изменило прогноз естественного течения заболевания. Тем не менее, международная система была протестирована для новейшей терапии и подтвердила свою надежность. Так, 5-летняя выживаемость больных в стадии I, II и III составила 66%, 45% и 18% соответственно.
В Международной системе не оказалось места для таких ценных прогностических показателей как число тромбоцитов, уровень лактатдегидрогеназы и свободных легких цепей в крови.
Число тромбоцитов в крови коррелирует с вытеснением костного мозга и имеет предсказательное значение выше, чем у альбумина. Содержание лактатдегидрогеназы (ЛДГ) коррелирует с общей массой миеломных клеток, недостаточным ответом на терапию и укорочением выживаемости. У больных с уровнем свободных легких цепей в крови свыше 4,75 г/л чаще выявляется почечная недостаточность, высокой процент миеломных клеток в пунктате костного мозга, высокие значения бета-2-микроглобулина и лактатдегдрогеназы, чаще обнаруживается болезнь отложения легких цепей и стадия III по Международной системе. Однако представленных доказательств оказалось недостаточно, чтобы включить эти три критерия в Международную систему. Но они были представлены в системе Дьюри-Саймона (1975), значение которой не оспаривается до сих пор.
Повышенный уровень сывороточного бета 2-микроглобулина, повышенный уровень лактатдегидрогеназы и низкий уровень сывороточного альбумина относятся к неблагоприятным признакам прогноза при миеломной болезни. Хотя уровень бета-2- микроглобулина увеличивается при почечной недостаточности, существует значительная корреляция между объемом опухолевой ткани и концентрацией этого биомаркера в крови. Исключение составляют лишь случаи, когда миеломная болезнь развивается уже на фоне имеющейся почечной недостаточности.
Перспективным методом оценки прогноза заболевания является генетическое исследование опухоль-ассоциированных генов. Цитогенетическое выявление транслокаций в отличие от трисомии относится к неблагоприятным прогностическим признакам. Метод флюоресцентной гибридизации in situ (FISH) позволил упростить выявление хромосомных аберраций в миеломных клетках, что предлагается исследователями клинико Мэйо (США) использовать для выбора индивидуальной лечебной тактики, исходя из прогноза для больного на основании учета выявленных аберраций. Генетические исследования хромосомных аномалий и мутаций при миеломе являются перспективными методами для лабораторной оценке прогноза и устойчивости к терапии при миеломе. Однако для их оценки требуются большие сроки и число пролеченных больных, чтобы определить способность новых средств терапии преодолеть цитогенетические показатели высокого риска при миеломной болезни.
Множественная миелома (миеломная болезнь)
Множественная миелома, миеломная болезнь, multiple myeloma.
При миеломной болезни появляются клинические проявления, которые объясняются пролиферацией миеломных клеток в костном мозге и действием продуцируемых ими иммуноглобулинов и свободных легких цепей. В результате вытеснения здорового костного мозга наблюдается угнетение нормального гемопоэза, что проявляется повышенной утомляемостью, объясняемой анемией, расстройством гемостаза из-за тромбоцитопении, рецидивами инфекции в результате гипогаммаглобулинемии или лейкопении. Пролиферация миеломных клеток и активность остеокластов приводят к гиперкальциемии, появлению «штампованных» дефектов костей и патологических переломов. Отложение моноклонального иммуноглобулина или свободных легких цепей оказывает прямое повреждение почек, приводя или к тубулярному, или гломерулярному повреждению (цилиндровой нефропатии или болезни отложения легких цепей соответственно), или к инфильтрации различных органов (сердца, печени, тонкой кишки, нервов), как в случае системного AL-амилоидоза. Синдром гипервязкости крови чаще развивается при повышенном IgA или IgM моноклональном иммуноглобулине (парапротеине) и может проявляться церебро-васкулярной или дыхательной недостаточностью. Повышенная скорость оседания эритроцитов может рассматриваться как маркер моноклональной гипергаммаглобулинемии и как нередкий повод для обследования пожилых больных.
Хотя у ряда лиц симптомы миеломы впервые обнаруживаются после 50 лет, средний возраст больных во время выявления болезни равен 66 годам, и только 2% пациентов моложе 40 лет. Миеломная болезнь развивается из иммунологического состояния, определяемого как моноклональная гаммапатия неизвестного значения (MGUS-англ. или МГНЗ) . Это состояние, по американской статистике, может быть выявлено у 2-4% населения старше 50 лет. Поскольку моноклональная гаммапатия не вызывает каких-либо жалоб, то определяется лишь как случайная лабораторная находка и является предраковым состоянием. Переход от моноклональной гаммапатии неизвестного значения к миеломной болезни за год отмечается у одного из 100 лиц, пораженных МГНЗ. Такая трансформация обычно наблюдается через промежуточную стадию тлеющей миеломы (smoldering multipe myelona- SMM), при которой риск прогрессии увеличивается в 10 раз т.е. до 10% в год. На фоне тлеющей миеломы отмечается резкое увеличение содержания парапротеина в крови, достигающего уровня развернутой миеломы.